[Tạp chí Người Nuôi Tôm] – Bài viết dưới đây do tiến sĩ Claude E. Boyd, hiện là Giáo sư danh dự tại Đại học Auburn viết về mối quan hệ giữa CO2 và pH; pH phụ thuộc vào lượng carbon dioxide trong nước, bất kỳ yếu tố nào làm thay đổi nồng độ carbon dioxide sẽ gây ảnh hưởng đến độ pH.

PH biểu thị nồng độ ion hydro trong nước và được định nghĩa là logarit âm của nồng độ phân tử ion hydro (-log [H+]). Nước được coi là có tính axit khi độ pH dưới 7 và có tính kiềm khi độ pH trên 7. Nước tinh khiết là loại nước đã được lọc sạch hoàn toàn và không có chứa các khoáng chất nên có nồng độ ion thấp. Ở 25o C, nước tinh khiết sẽ có độ pH là 7, có số lượng ion hydro (H+) và hydroxyl (OH–) bằng nhau (1):
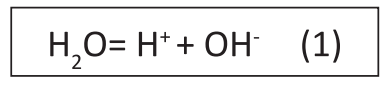
Vì nước tinh khiết có nồng độ mol H+ và OH– bằng nhau nên nó trung tính trong phản ứng, không có tính axit cũng không có tính bazơ (kiềm). Độ pH của nước tinh khiết ở 25°C là 7 và nước có phản ứng trung tính, nhưng ở nhiệt độ thấp hơn, điểm trung hòa có độ pH cao hơn một chút và ngược lại.
Carbon dioxide (CO2) hòa tan trong nước và phản ứng với nước tạo ra ion H+ và bicarbonat (HCO3–) ở dạng cấu thành mol rất nhỏ nhưng bằng nhau (2).
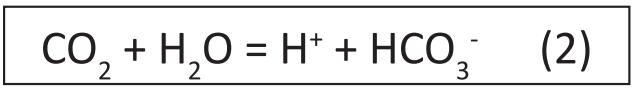
Nước tinh khiết là loại nước đã được lọc sạch hoàn toàn và không có chứa các khoáng chất nên có nồng độ ion thấp. Ở nhiệt độ 25o C, nước tinh khiết sẽ có độ pH là 7.0. Tuy nhiên, nếu để lâu trong không khí, nước sẽ tiếp xúc với carbon dioxide ở trong khí quyển và tạo nên sự cân bằng. Sự cân bằng ấy sẽ làm giảm độ pH xuống còn khoảng 5, 6.
Carbon dioxide đi vào nước từ không khí, và từ quá trình hô hấp của các sinh vật dưới nước. Nồng độ carbon dioxide trong nước tự nhiên thường lớn hơn nồng độ cân bằng carbon dioxide trong khí quyển. Ngoài ra, bicacbonat thường có nhiều trong nước tự nhiên hơn trong nước tinh khiết. Điều này là kết quả của việc hòa tan các khoáng chất như đá vôi, calcium silicate và feldspar mà nước tiếp xúc.
Phản ứng trong phương trình 2 đạt đến trạng thái cân bằng tại đó nồng độ của các chất phản ứng (CO2 và nước) và các sản phẩm (ion hydro và bicacbonat) có tỷ lệ nồng độ mol cụ thể được xác định bởi hằng số cân bằng (K) như minh họa bên dưới (3).
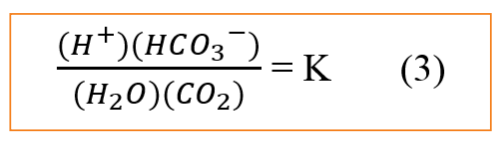
Tuy nhiên, nước phân ly rất ít, nồng độ mol không bị ảnh hưởng và phương trình 3 có thể được viết lại là (4).
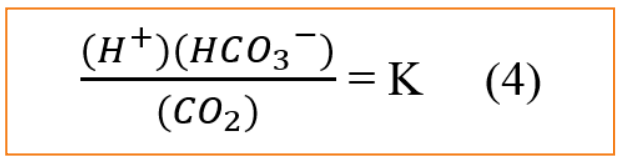
Trong phản ứng của carbon dioxide và nước, K có giá trị là 10-6,35 ở 25°C. Khi nồng độ bicarbonat là 61 mg/L (0,001 mol), độ pH là 7,0 (10-7M tính bằng H+), nồng độ carbon dioxide cần thiết cho hằng số cân bằng (K=10-6,35) là 10-3,65M hoặc 9,85 mg/L. Nồng độ carbon dioxide ở các giá trị pH khác nhau được tính theo phương trình 4 minh họa rằng khi carbon dioxide được loại bỏ, độ pH tăng lên.
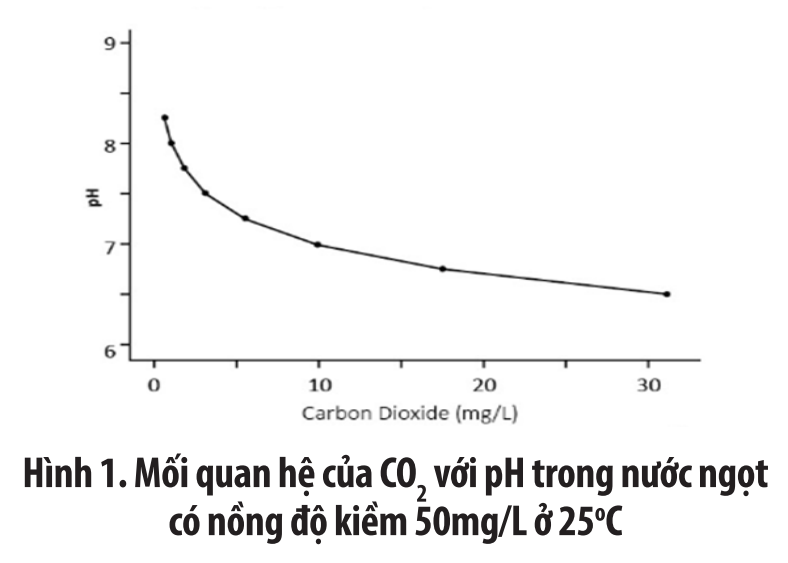
Độ pH trong ao nuôi trồng thủy sản thường tăng vào ban ngày khi thực vật sử dụng CO2 cho quá trình quang hợp. Vào ban đêm, sinh vật trong ao hô hấp giải phóng CO2 và làm cho pH giảm. Trong các hệ thống sản xuất khác, quy trình loại bỏ carbon dioxide sẽ làm tăng độ pH và ngược lại.
Độ kiềm thấp hơn cũng sẽ làm giảm lượng carbon dioxide trong nước ở nồng độ pH cụ thể. Ở mức 61mg/L bicarbonat (độ kiềm 50 mg/L), nước chứa 9,9 mg/L carbon dioxide tại pH 7. Ở 30 mg/L hoặc 10-3,31 mol bicarbonat (kiềm 25 mg/L), nước sẽ chỉ giữ 4,82 mg/L carbon dioxide tại pH 7.
Nhiệt độ nước cũng ảnh hưởng đến nồng độ carbon dioxide ở pH cụ thể. Nước ở 10°C, K cho phản ứng của carbon dioxide trong nước ngọt là 10-6,69, và nồng độ carbon cao hơn sẽ dẫn đến kết quả ở 25°C.
Nước được coi là không có carbon dioxide ở độ pH trên 8,3-8,4, nhưng thực vật thủy sinh có thể thu được carbon dioxide để sử dụng trong quá trình quang hợp từ bicarbonate. bicarbonat được thực vật hấp thụ và thông qua phản ứng được xúc tác bởi enzyme carbonic anhydrase, hai ion bicacbonat được chuyển đổi thành Carbon dioxide và ion Carbonat (CO32-) (5).
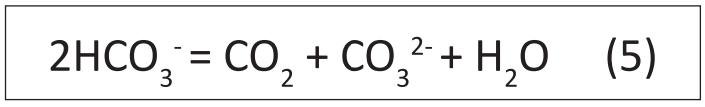
Khí Carbonic giải phóng trong phương trình 5 được sử dụng trong quá trình quang hợp. Các ion carbonat được giải phóng vào nước sẽ thủy phân loại bỏ H+ và làm cho độ pH tăng (trên 8,3 và có thể đạt tới 9,0 hoặc hơn). Carbon dioxide được giải phóng vào ban đêm từ quá trình hô hấp sẽ chuyển hóa carbonat trở lại thành bicarbonat làm giảm pH, và khi không còn carbonat, carbon dioxide tiếp tục được giải phóng khiến pH tiếp tục giảm. Nước có độ kiềm cao và nồng độ canxi cao, carbonat phản ứng với canxi tạo ra kết tủa canxi carbonat. Trong hệ thống tuần hoàn nước hoặc trong trại sản xuất giống, sự kết tủa của canxi carbonat có thể gây hại cho trứng cá và ấu trùng, đồng thời có thể gây đóng cặn trên các bề mặt trong hệ thống.
Thông thường, 20 mg/L hoặc có thể nhiều hơn carbon dioxide sẽ có ít hoặc không có tác hại đối với động vật thủy sinh trong nước có nồng độ oxy hòa tan thích hợp. Nồng độ carbon dioxide tăng cao đặc biệt có hại khi nồng độ oxy hòa tan thấp, vì nó ức chế sự bão hòa của huyết sắc tố trong máu cá và có lẽ là hemocyanin trong máu động vật không xương sống. Nồng độ oxy hòa tan thấp thường liên quan đến nồng độ CO2 cao, CO2 được giải phóng thông qua quá trình hô hấp với tốc độ lớn hơn với oxy hòa tan được cung cấp bởi quá trình quang hợp hoặc các phương tiện khác.
Nồng độ carbon dioxide trong ao nuôi trồng thủy sản thường thấp vào ban ngày, nhưng có thể vượt quá 20 mg/L vào ban đêm. Nồng độ carbon dioxide thường cao nhất khi nồng độ oxy hòa tan thấp nhất.
Nồng độ carbon dioxide cao trong nước cản trở sự bài tiết carbon dioxide qua mang cá. Điều này làm tăng nồng độ carbon dioxide trong huyết tương, làm giảm độ pH của máu. Tình trạng này làm giảm khả năng liên kết oxy của huyết sắc tố và giảm sự hấp thu oxy của máu ở mang, ngay cả khi nồng độ oxy hòa tan cao. Tác động tổng thể của nồng độ carbon dioxide trong nước tăng cao là làm giảm hiệu quả hô hấp và khả năng chịu đựng của động vật thủy sinh đối với nồng độ oxy hòa tan thấp.
Ở nồng độ oxy hòa tan nhất định (ví dụ: 2 mg/L), cá có thể bị ngạt khi nồng độ CO2 cao và dường như không bị ảnh hưởng khi CO2 thấp. Cá da trơn có thể chịu được 20-30 mg/L CO2 nếu quá trình tích lũy chậm và nồng độ oxy hòa tan trên 5 mg/L.
Carbon dioxide, pH và độ kiềm có mối liên quan mật thiết với nhau và có thể có ảnh hưởng sâu sắc đến năng suất, mức độ căng thẳng và sức khỏe của động vật thủy sinh và độc tính của amoniac cũng như một số kim loại trong ao nuôi. CO2 là nguồn tạo ra axit chủ yếu trong ao nuôi làm pH giảm vì vậy khi độ kiềm cao thì khả năng trung hòa CO2 càng tốt.
Thu Hiền (Theo Aqua Practical)
- Tôm rũ càng, người nuôi… rũ ruột
- Thừa Thiên Huế: Chọn giống chất lượng, qua kiểm dịch để thả nuôi
- Bánh dầu đậu phộng lên men: Giảm giá thành nuôi tôm
- Cập nhật giá tôm thẻ kiểm kháng sinh ngày 26/4/2024
- Đã xác định tác nhân gây tôm hùm bông chết ở Khánh Hòa
- Hà Tĩnh: Siết chặt quản lý thuốc thú y thủy sản
- Trung Quốc hiện đang yêu cầu gì với thủy sản sống xuất khẩu?
- Rong sụn: Bảo vệ tôm chống lại vi khuẩn Vibrio harveyi
- Kết nối giao thương giữa doanh nghiệp tỉnh Cà Mau và doanh nghiệp Trung Quốc
- Viet Nhat Group: Động thổ giai đoạn 2 dự án nhà máy sản xuất thức ăn chăn nuôi và thủy sản Việt Nhật
Tin mới nhất
CN,28/04/2024
- Tôm rũ càng, người nuôi… rũ ruột
- Thừa Thiên Huế: Chọn giống chất lượng, qua kiểm dịch để thả nuôi
- Bánh dầu đậu phộng lên men: Giảm giá thành nuôi tôm
- Cập nhật giá tôm thẻ kiểm kháng sinh ngày 26/4/2024
- Đã xác định tác nhân gây tôm hùm bông chết ở Khánh Hòa
- Hà Tĩnh: Siết chặt quản lý thuốc thú y thủy sản
- Trung Quốc hiện đang yêu cầu gì với thủy sản sống xuất khẩu?
- Rong sụn: Bảo vệ tôm chống lại vi khuẩn Vibrio harveyi
- Kết nối giao thương giữa doanh nghiệp tỉnh Cà Mau và doanh nghiệp Trung Quốc
- Viet Nhat Group: Động thổ giai đoạn 2 dự án nhà máy sản xuất thức ăn chăn nuôi và thủy sản Việt Nhật
Các ấn phẩm đã xuất bản
- Gói tín dụng 15.000 tỷ đồng: Trợ lực giúp doanh nghiệp vượt khó
- Sri Lanka: Ra mắt gói bảo hiểm rủi ro cho các trang trại tôm đầu tiên tại châu Á
- Hội chợ triển lãm Công nghệ ngành Thủy sản Việt Nam lần đầu tiên tổ chức tại miền Bắc
- USSEC: Hướng tới kỷ nguyên nuôi biển bền vững tiến xa bờ
- BTC FISTECH và Chi Cục Thủy sản Quảng Ninh: Họp bàn kế hoạch phối hợp tổ chức FISTECH 2023
- Diện tích và sản lượng tôm nước lợ năm 2022
- Ngành thuỷ sản miền Bắc – miền Trung: “Sân chơi” đầy sức hút
- Long Thăng: Triển khai chương trình “Tôm to xế xịn 2023”
- Hiệu quả vượt trội với mô hình nuôi cá điêu hồng Thăng Long
- Năm mới, nỗi lo cũ: “Làm sao để tăng cường đề kháng cho tôm?”
- Máy sưởi ngâm: Cách mạng hóa nghề nuôi tôm ở Việt Nam
- Waterco: Giải pháp thiết bị hàng đầu trong nuôi trồng thủy sản
- GROSHIELD: “Trợ thủ đắc lực” giúp tôm đề kháng vững vàng hàng ngày, sẵn sàng về đích
- Năm mới, nỗi lo cũ: “Làm sao để tăng cường đề kháng cho tôm?”
- Vi sinh: Giải pháp mục tiêu toàn diện
- Grobest Việt Nam: Tiên phong ra mắt sản phẩm thức ăn chức năng hàng ngày Groshield, nâng cao tối đa sức đề kháng, hướng đến những vụ tôm về đích thành công trong năm tới
- Solagron Vietnam: Nhà sản xuất vi tảo công nghiệp đầu tiên mang dấu ấn Việt Nam
- Giải pháp giảm phát thải trong nuôi trồng thủy sản từ bột cá thủy phân
- Solagron Việt Nam: Ra mắt sản phẩm vi tảo ngôi sao Thalas*Algae dành cho tôm giống
- Xử lý triệt để nấm và vi khuẩn có hại trong ao tôm giống và tôm thịt














































