[Tạp chí Người Nuôi Tôm] – Nghiên cứu cho thấy, tỏi lên men có độ nhạy cao đối với cả 2 chủng vi khuẩn gây bệnh hoại tử gan tụy cấp tính (EMS/AHPND) khi thử nghiệm ở 25μl và 30μl. Bổ sung dịch tỏi lên men với liều 15 ml/kg thức ăn/ngày vào thức ăn cho tôm ăn trong 10 ngày liên tục đã có khả năng phòng (EMS/AHPND) cho tôm.

Nghiên cứu mở ra tiềm năng ứng dụng sản phẩm tỏi lên men để phòng bệnh AHPND cho tôm nuôi nước lợ (nguồn: medinet)
VẬT LIỆU NGHIÊN CỨU
Củ tỏi ta (Allium sativum L.) bóc bỏ lớp vỏ lụa bên ngoài, sau đó cắt nhỏ các tép tỏi, phối trộn cùng với rượu và mật ong theo tỷ lệ 10kg tỏi: 10 lít rượu: 1 lít mật ong. Chuyển nguyên liệu đã phối trộn vào thùng/xô nhựa có nắp đậy ủ cho lên men trong thời gian 25-30 ngày ở 30-35oC. Sau thời gian ủ, lọc bỏ phần bã của củ tỏi, phần dịch tỏi lên men được sử dụng để thử khả năng kháng khuẩn và hiệu quả phòng AHPND cho tôm.
Tôm thẻ chân trắng có khối lượng khoảng 3-4 g/con, kích thước đồng đều, phản xạ nhanh, ruột đầy thức ăn, có kết quả âm tính với virus gây bệnh đốm trắng và các loài vi khuẩn gây AHPND. Bể composit có thể tích 200 L/bể, muối biển nhân tạo dùng để pha nước nuôi tôm ở độ mặn 15‰.
Các chủng vi khuẩn thử nghiệm bao gồm V. parahaemolyticus KC.13.14.2 và V. harveyi KC.13.17.5 gây AHPND ở tôm nuôi nước lợ tại Nghệ An.
PHƯƠNG PHÁP NGHIÊN CỨU
Đánh giá khả năng kháng khuẩn của sản phẩm tỏi lên men:
Khảo sát hoạt tính kháng khuẩn của sản phẩm tỏi lên men bằng phương pháp kháng sinh đồ khuếch tán trên đĩa thạch Kirby-Bauer. Nhỏ sản phẩm tỏi lên men lên các khoanh giấy vô trùng với 6 thể tích để tiến hành thử nghiệm bao gồm 5,10, 15, 20, 25 và 30 μl/khoanh giấy. Khoanh giấy tẩm kháng sinh Doxycyclin (30μg) được sử dụng như đối chứng dương, khoanh giấy nhỏ nước cất được sử dụng như đối chứng âm. Dùng que trang trang đều 100μl vi khuẩn ở mật độ 108 cfu/ml lên thạch Mueller Hinton, đặt các đĩa giấy đã thấm sản phẩm tỏi lên men và đối chứng vào, sau đó ủ trong tủ ấm ở 29oC. Sau 24h nuôi cấy, đĩa thạch được lấy ra để đo đường kính vòng vô khuẩn. Đường kính vòng vô khuẩn ≥16 mm: nhạy (dịch tỏi lên men có độ nhạy với vi khuẩn).
KẾT QUẢ NGHIÊN CỨU
Khả năng diệt khuẩn của tỏi lên men đối với các chủng vi khuẩn gây AHPND
Kết quả thử nghiệm ở nồng độ 5μl, sản phẩm tỏi lên men không tạo được vòng vô khuẩn đối với cả 2 chủng vi khuẩn thử nghiệm là V. parahaemolyticus KC.13.14.2 và V. harveyi KC.13.17.5. Khi thử nghiệm ở các nồng độ cao hơn là 10, 15 và 20μl, sản phẩm tỏi lên men tạo ra vòng kháng khuẩn trung bình dao động từ 7,2-13,8mm (chủng KC.13.14.2) và 8,0-14,6mm (chủng KC.13.17.5). Chỉ khi nâng nồng độ thử nghiệm lên 25 và 30μl thì sản phẩm tỏi lên men mới tạo ra vòng kháng khuẩn có độ nhạy cao đối với cả 2 chủng vi khuẩn thử nghiệm. Đường kính vòng vô khuẩn trung bình đạt được lần lượt là 16,8-18,2mm (KC.13.14.2) và 17,2-18,8mm (KC.13.17.5). Trong khi đó, đối chứng Doxycyclin cũng chỉ tạo ra đường kính vòng vô khuẩn trung bình 22,8-24,0mm giữa hai chủng (Hình 1).
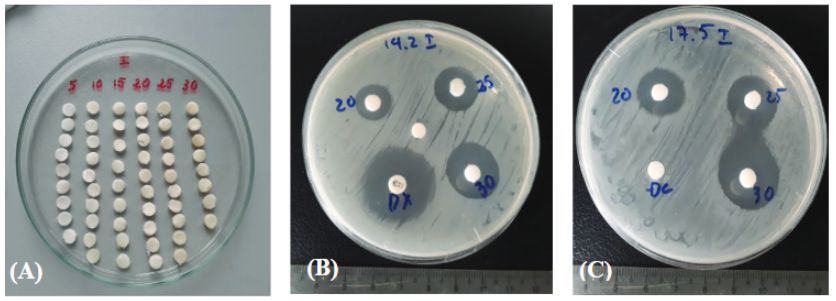
Hình 1. Khả năng diệt khuẩn của tỏi lên men đối với vi khuẩn gây AHPND trên tôm.
(A) Đĩa giấy tẩm dịch chiết tỏi; (B) Đường kính vòng vô khuẩn của tỏi lên men khi thử với vi khuẩn V. parahaemolyticus KC.13.14.2 gây AHPND; (C) Đường kính vòng vô khuẩn của tỏi lên men khi thử với vi khuẩn V. harveyi KC.13.17.5 gây AHPND; ĐC: đối chứng âm; Dx: Doxycyclin (30μg)
Đối với chủng V. parahaemolyticus KC.13.14.2 khi nâng nồng độ thử nghiệm từ 25 lên 30μl, đường kính vòng vô khuẩn tăng từ 16,8 lên 18,2mm, khoảng cách này tạo ra sự sai khác có ý nghĩa về mặt thống kê (p<0,05). Trong khi đó, khi nâng nồng độ thử nghiệm từ 25 lên 30μl đối với chủng V. harveyi KC.13.17.5, đường kính vòng vô khuẩn tạo ra từ 2 nồng độ lại không có sự sai khác có ý nghĩa thống kê (Hình 1).
Nghiên cứu này cho thấy tỏi lên men có tính nhạy đối với cả 2 chủng vi khuẩn gây AHPND là V. harveyi KC.13.17.5 và V. Parahaemolyticus KC.13.14.2 khi thử nghiệm ở thể tích ≥25μl (đường kính vòng vô khuẩn >16mm).
Khả năng phòng bệnh của tỏi lên men đối với AHPND trên tôm thẻ chân trắng
Trong 10 ngày đầu, tôm thẻ chân trắng ở các thí nghiệm được ăn thức ăn có bổ sung dịch tỏi lên men để phòng AHPND, từ ngày thứ 11 đến cuối thí nghiệm tôm ăn thức ăn viên công nghiệp không bổ sung dịch tỏi lên men, các bể ở thí nghiệm đối chứng tôm ăn thức ăn viên công nghiệp không trộn dịch tỏi lên men trong suốt thời gian thí nghiệm. Riêng các bể đối chứng âm và dương tôm ăn thức ăn viên công nghiệp, không bổ sung dịch tỏi lên men.
Kết quả cho thấy, tôm ở tất cả các nghiệm thức thí nghiệm đều ăn hết thức ăn, phản xạ nhanh nhẹn, màu sắc sáng và không thấy có tôm chết. Đến ngày thứ 11 (ngày đầu tiên gây nhiễm), tất cả các nghiệm thức thí nghiệm có gây nhiễm vi khuẩn đều có tôm chết với tỷ lệ chết từ 1,1 đến 7,7%. Tôm chết nhanh sau 2-4 ngày gây nhiễm và dừng chết sau 7 ngày gây nhiễm. Cuối thí nghiệm, tỷ lệ tôm chết cao nhất là nghiệm thức đối chứng dương với tỷ lệ chết cộng dồn là 86%. Tiếp đến là nghiệm thức CT1 với tỷ lệ chết cộng dồn là 58%. Nghiệm thức CT2 và nghiệm thức CT3 có tỷ lệ chết cộng dồn lần lượt là 47 và 49%. Trong khi đó, nghiệm thức đối chứng âm tôm không có hiện tượng chết (hình 2). Kết quả này cho thấy, sản phẩm tỏi lên men có hiệu quả trong việc kiểm soát độc lực của vi khuẩn V. parahaermolyticus KC.13.14.2 gây AHPND trên tôm.
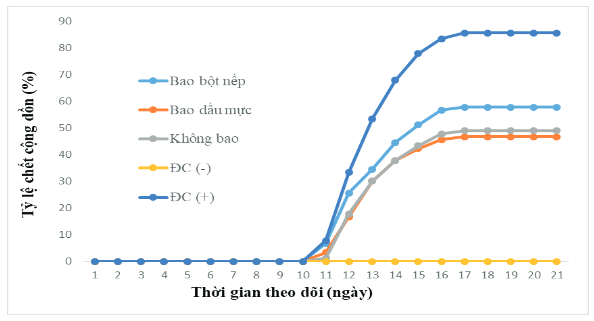
Hình 2. Tỷ lệ chết cộng dồn của tôm trong thí nghiệm đánh giá khả năng phòng AHPND của tỏi lên men
Kết quả thí nghiệm cũng chỉ rõ, khi bổ sung sản phẩm tỏi lên men vào thức ăn cho tôm với liều lượng 15 ml/kg thức ăn/ngày liên tục trong 10 ngày đã có tác dụng nâng cao tỷ lệ sống của tôm khi công cường độc vi khuẩn gây AHPND. Trong đó, hình thức sử dụng dầu gan mực để bao ngoài (CT2) có hiệu quả cao nhất, tỷ lệ sống của tôm ở nghiệm thức này là 53%, ở nghiệm thức không sử dụng chất bao ngoài (CT3) là 51%, còn ở nghiệm thức sử dụng bột nếp để bao ngoài (CT1) là 42% so với tôm ở nghiệm thức đối chứng dương có tỷ lệ sống chỉ đạt 14% và đối chứng âm là 100%. Khi so sánh tỷ lệ sống của tôm giữa hai nghiệm thức có hiệu quả cao nhất khi sử dụng sản phẩm tỏi lên men để phòng AHPND là nghiệm thức sử dụng dầu gan mực để bao ngoài và nghiệm thức không sử dụng chất bao ngoài cho thấy không có sự khác nhau có ý nghĩa thống kê (p>0,05). Tuy nhiên, lại có sự khác nhau có ý nghĩa thống kê so với nghiệm thức đối chứng dương của thí nghiệm (p<0,05).

Hình 3. Biểu hiện của tôm sau khi gây nhiễm vi khuẩn gây AHPND.
(I) Tôm chết ở nghiệm thức sử dụng bột nếp để bao ngoài; (II) Tôm chết ở nghiệm thức sử dụng dầu mực để bao ngoài; (III) Tôm chết ở nghiệm thức đối chứng dương; (IV) Tôm ở ng hiệm thức đối chứng âm.
Tôm chết ở các nghiệm thức sau khi công cường độc vi khuẩn gây AHPND có các biểu hiện bệnh như gan tụy chuyển màu trắng hoặc đỏ (mũi tên chỉ ở Hình 3-III), vỏ mềm (mũi tên chỉ ở Hình 3-II), màu sắc nhợt nhạt và ruột tôm không có thức ăn (mũi tên chỉ ở Hình 3-I). Trong khi đó, tôm ở lô đối chứng âm màu sắc tươi sáng, gan tụy đen, ruột đầy thức ăn (Hình 3-IV). Những biểu hiện của tôm sau gây nhiễm này hoàn toàn giống với những biểu hiện của tôm bị nhiễm AHPND đã được công bố.
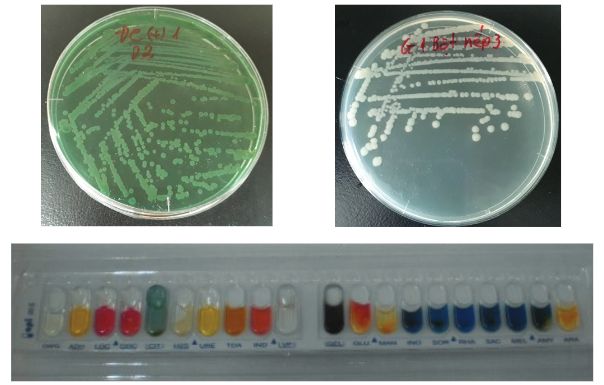
Hình 4. Khuẩn lạc và đặc điểm sinh hóa của vi khuẩn V. parahaemolyticus tái phân lập lại từ tôm chết/yếu ở các nghiệm thức thí nghiệm.
Trong quá trình thí nghiệm, tôm chết ở các nghiệm thức được thu để nuôi cấy và tái phân lập lại vi khuẩn gây nhiễm. Kết quả nuôi cấy và định danh vi khuẩn cho thấy, 100% mẫu thu khi tôm vừa mới chết/yếu vào ngày thứ 12 và 15 của thí nghiệm (sau 2 và sau 5 ngày công cường độc) đều dương tính với vi khuẩn V. parahaemolyticus. Các chủng vi khuẩn phân lập được đều có phản ứng sinh hóa trùng khớp với chủng V. parahaemolyticus KC.13.14.2 ban đầu đem gây nhiễm. Điều đó khẳng định, tôm trong các nghiệm thức gây nhiễm vi khuẩn bị chết là do độc lực của vi khuẩn gây nhiễm. Trong khi đó, 100% mẫu tôm sống thu ở các nghiệm thức vào ngày thứ 21 (ngày cuối) của thí nghiệm lại cho kết quả âm tính với vi khuẩn V. parahaemomyticus. (Hình 4). Kết quả kiểm tra tác nhân gây AHPND trên tôm bằng kỹ thuật PCR cũng đã khẳng định, tôm chết sau khi công cường độc vi khuẩn ở các nghiệm thức thí nghiệm là do nhiễm vi khuẩn V. parahaemolyticus gây AHPND.
Trước khi kết thúc thí nghiệm, tôm còn sống ở các nghiệm thức được thu để kiểm tra AHPND, tất cả các mẫu kiểm tra đều âm tính với AHPND. Điều đó cho thấy, gan tụy tôm còn sống trong thí nghiệm đã đào thải hết vi khuẩn V. parahaemolyticus gây nhiễm ban đầu.
Kết luận
Nghiên cứu cho thấy, sản phẩm tỏi lên men có độ nhạy cao đối với cả 2 chủng vi khuẩn V. parahaemolyticus KC.13.14.2 và V. harveyi KC.13.17.5 gây AHPND. Trong điều kiện phòng thí nghiệm, bổ sung tỏi lên men với liều 15 ml/kg thức ăn/ngày vào thức ăn rồi bao ngoài bằng dầu mực cho tôm ăn trong 10 ngày liên tục có khả năng nâng cao tỷ lệ sống của tôm lên 53%, cao hơn nghiệm thức không sử dụng chất bao ngoài (51%), bao ngoài bằng bột nếp (42%) và cao hơn so với đối chứng dương tôm chỉ ăn thức ăn thường không bổ sung sản phẩm tỏi lên men (14%).
Ngọc Anh (Biên tập)
- Công nghệ Nanobubble: Nâng cao hiệu suất tôm tại cơ sở Ras
- NANOBUBBLE VÀ PAC: Giải pháp tối ưu trong quản lý chất lượng nước ao nuôi
- Vương Quốc Anh: Thúc đẩy mô hình nuôi tôm sú trên đất liền
- Quảng Trị: Khuyến nông thúc đẩy mô hình nuôi tôm sú hai giai đoạn
- Nuôi tôm trong nhà tại châu Âu: Bài toán đầu tư và cuộc đua tìm mô hình khả thi
- Tôm Ấn Độ xoay trục sang EU, gia tăng sức ép cạnh tranh với Việt Nam
- Đón đọc Tạp chí Người Nuôi Tôm số tháng 2/2026
- Sản lượng tôm tăng mạnh vào tháng đầu năm, xuất khẩu hưởng lợi từ nhu cầu dịp Tết
- Quảng Trị: Nuôi tôm trong bể nổi xi măng, giải pháp nuôi trồng bền vững
- Giá tôm liên tục dao động dịp cận Tết
Tin mới nhất
T4,18/02/2026
- Công nghệ Nanobubble: Nâng cao hiệu suất tôm tại cơ sở Ras
- NANOBUBBLE VÀ PAC: Giải pháp tối ưu trong quản lý chất lượng nước ao nuôi
- Vương Quốc Anh: Thúc đẩy mô hình nuôi tôm sú trên đất liền
- Quảng Trị: Khuyến nông thúc đẩy mô hình nuôi tôm sú hai giai đoạn
- Nuôi tôm trong nhà tại châu Âu: Bài toán đầu tư và cuộc đua tìm mô hình khả thi
- Tôm Ấn Độ xoay trục sang EU, gia tăng sức ép cạnh tranh với Việt Nam
- Đón đọc Tạp chí Người Nuôi Tôm số tháng 2/2026
- Sản lượng tôm tăng mạnh vào tháng đầu năm, xuất khẩu hưởng lợi từ nhu cầu dịp Tết
- Quảng Trị: Nuôi tôm trong bể nổi xi măng, giải pháp nuôi trồng bền vững
- Giá tôm liên tục dao động dịp cận Tết
Các ấn phẩm đã xuất bản
- Giá tôm xuất khẩu tăng mạnh, tạo động lực phục hồi sản xuất và nâng tầm giá trị ngành tôm
- Gần 500 hộ nuôi khẳng định hiệu quả Advance Pro – Tiến bộ kỹ thuật của Grobest
- Người nuôi tôm phập phồng với “ngày nắng, đêm mưa”
- Động lực phát triển đột phá ngành thủy sản
- Công nghệ sinh học toàn diện: Giải pháp nuôi tôm thành công từ Tâm Việt
- Biện pháp kiểm soát khí độc Nitrite (NO2) trong mô hình nuôi tôm TLSS-547
- Ngành chức năng và nông dân Quảng Nam cùng gỡ khó cho nuôi tôm nước lợ
- Thời tiết bất lợi gây thiệt hại hơn 27 triệu con tôm sú, tôm thẻ nuôi
- [Tuyển dụng] – Công ty TNHH Seven Hills Trading tuyển dụng nhiều vị trí hấp dẫn trong năm 2025
- Nhiều diện tích tôm nuôi của Nghệ An bị bệnh đốm trắng
- An toàn sinh học: Giải pháp then chốt cho bài toán dịch bệnh thủy sản
- Sử dụng sóng siêu âm để tính sinh khối ao nuôi tôm
- Máy sưởi ngâm: Cách mạng hóa nghề nuôi tôm ở Việt Nam
- Waterco: Giải pháp thiết bị hàng đầu trong nuôi trồng thủy sản
- GROSHIELD: “Trợ thủ đắc lực” giúp tôm đề kháng vững vàng hàng ngày, sẵn sàng về đích
- Năm mới, nỗi lo cũ: “Làm sao để tăng cường đề kháng cho tôm?”
- Vi sinh: Giải pháp mục tiêu toàn diện
- Grobest Việt Nam: Tiên phong ra mắt sản phẩm thức ăn chức năng hàng ngày Groshield, nâng cao tối đa sức đề kháng, hướng đến những vụ tôm về đích thành công trong năm tới
- Solagron Vietnam: Nhà sản xuất vi tảo công nghiệp đầu tiên mang dấu ấn Việt Nam
- Giải pháp giảm phát thải trong nuôi trồng thủy sản từ bột cá thủy phân
















































