[Tạp chí Người Nuôi Tôm] – Hiện nay, chế phẩm sinh học được ứng dụng trong điều trị các bệnh do vi khuẩn và cho hiệu quả rất rõ ràng. Trong số các loài vi khuẩn được sử dụng rộng rãi, khả năng ứng dụng của Bacillus spp. đã được chứng minh trên nhiều loại động vật thủy sinh, đặc biệt là tôm.
Bệnh hoại tử gan tụy cấp tính (AHPND) do vi khuẩn Vibrio parahaemolyticus gây ra, xảy ra trong suốt những năm qua khiến sản lượng tôm toàn cầu giảm mạnh ở một số vùng nuôi trọng điểm. Bên cạnh đó, các liệu pháp điều trị truyền thống như hóa chất và kháng sinh được sử dụng trong các hệ thống nuôi tôm cũng đưa đến những nguy cơ về môi trường, kháng thuốc và mất an toàn thực phẩm. Dựa trên các kết quả nghiên cứu và hiệu quả từ việc áp dụng trên thực tế của các chế phẩm sinh học hoặc prebiotics, hướng đi không chỉ có thể được sử dụng để kiểm soát các bệnh truyền nhiễm trong quá trình nuôi tôm mà còn cũng có khả năng cải thiện hiệu quả tăng trưởng, khả năng miễn dịch bẩm sinh và khả năng kháng bệnh. Hiện nay, chế phẩm sinh học được ứng dụng trong điều trị các bệnh do vi khuẩn và cho hiệu quả rất rõ ràng. Trong số các loài vi khuẩn được sử dụng rộng rãi, khả năng ứng dụng của Bacillus spp. đã được chứng minh trên nhiều loại động vật thủy sinh, đặc biệt là tôm.
Synbiotics được định nghĩa là hỗn hợp của probiotics và prebiotics (chất xơ không tiêu hóa probiotics phát triển). Ứng dụng của synbiotics trong nuôi trồng thủy sản rất đa dạng. Synbiotics có thể tăng cường sức khỏe của hệ vi sinh vật đường ruột, điều chỉnh sức khỏe vật chủ trực tiếp qua đường tiêu hóa và ngăn ngừa sự xuất hiện của các tình trạng rối loạn sinh học, và hiệu quả cao của synbiotics đã được báo cáo trong nhiều nghiên cứu trước đây. Tuy nhiên, sự tồn tại của probiotic trong quá trình bảo quản làm thức ăn chăn nuôi qua đường tiêu hóa vẫn là những vấn đề cần được giải quyết, vì các yếu tố lý hóa có thể ảnh hưởng đến khả năng tồn tại của vi khuẩn. Do đó, để giảm thiểu sự hao hụt và nâng cao hiệu quả của probiotic, chitosan, một chất phủ đầy hứa hẹn cho việc bao bọc vi sinh probiotic, đã được sử dụng để nâng cao hiệu quả của nhiều chủng probiotic. Do tính không độc hại, tính tương hợp sinh học và khả năng phân hủy sinh học của chitosan, nó tương đối an toàn và được chấp nhận để sử dụng trong thức ăn chăn nuôi. Trong các nghiên cứu trước đây, người ta đã báo cáo rằng chitosan có thể được ứng dụng như một prebiotic có hiệu lực cao, ngoài ứng dụng của nó như một lớp phủ cho vi bào. Ngoài ra, sự thủy phân một phần của nó có thể cung cấp chitooligosaccharide (COS), với các chức năng và tác dụng sinh học tốt, chẳng hạn như thúc đẩy hiệu suất tăng trưởng và phản ứng miễn dịch và kích thích sự phát triển của hệ vi sinh vật đường ruột. Vì vậy, nghiên cứu mới đây của nhóm nghiên cứu Đại học Kasetsart (Thái Lan) đã được thực hiện nhằm điều tra tác động của Bacillus spp. hỗn hợp probiotic được bổ sung với chitosan về hiệu suất tăng trưởng và phản ứng miễn dịch của tôm thẻ chân trắng và để kiểm tra hiệu quả của chúng chống lại AHPND.
Tôm thẻ chân trắng (khối lượng ban đầu: 3,16 ± 0,86 g) được mua từ một trang trại tư nhân ở Chonburi, Thái Lan. Tôm được nuôi thích nghi trong các bể dung tích 3.000L trong 1 tuần, với môi trường được sử dụng là nước biển có độ mặn 25ppt và sục khí liên tục. Trong thời gian thích nghi, tôm được cho ăn thức ăn công nghiệp với tỷ lệ 3% trọng lượng cơ thể và 3 lần một ngày. Sau đó, 60 con tôm được đặt ngẫu nhiên vào 15 bể nhựa (500L/bể) tương ứng với 5 nghiệm thức thức ăn với 3 lần lặp lại. 3 chủng vi khuẩn Bacillus. sp, cụ thể là Bacillus amyloliquefaciens (A), Bacillus pumilus (P) và Bacillus subtilis (S), được cung cấp bởi Phòng thí nghiệm NTTS, Khoa NTTS, Đại học Kasetsart với nồng độ cuối cùng của huyền phù là khoảng 5 × 108 (CFU)/mL. Thức ăn thương mại cho tôm (nhà máy thức ăn chăn nuôi Liên hiệp Thái Lan, Thái Lan) (1kg) được phủ bên ngoài bằng hỗn hợp probiotic (P:A), (P:S) và (A:S) với tỷ lệ nồng độ 5 × 108 CFU/200 mL dung dịch NaCl 0,85%. Sau khi hoàn thiện phủ tất cả ba công thức, thức ăn được phủ 20mL prebiotic chitosan (C) (18% w/w) do Greater Vet Thailand (Nonthaburi, Thái Lan) cung cấp, để xây dựng các thức ăn riêng biệt cho các nghiệm thức PAC, PSC và ASC. Tôm thí nghiệm được cho ăn các loại thức ăn tương ứng với từng nghiệm thức (Đối chứng; C – chỉ có chitosan; PAC – Bacillus pumilus + Bacillus amyloliquefaciens + Chitosan; PSC – Bacillus pumilus + Bacillus subtilis + Chitosan; ASC – Bacillus amyloliquefaciens + Bacillus subtilis + Chitosan), với tỷ lệ 5% trọng lượng cơ thể một ngày và kéo dài trong 5 tuần.
Trong quá trình thử nghiệm, chất lượng nước của tất cả các bể thí nghiệm được phân tích hàng tuần. Ngoài ra, nhiệt độ, độ pH và hàm lượng oxy hòa tan (DO) được xác định hàng ngày bằng cách sử dụng YSI pH100A và YSI550A (Hoa Kỳ). Độ kiềm, độ cứng, tổng mức amoniac (NH3 – N) và nitrit (NO2 – N) được phân tích bằng các phương pháp tiêu chuẩn của APHA. Chất lượng nước được kiểm soát ở điều kiện tăng trưởng tối ưu cho tôm, với nhiệt độ 28–30°C; độ mặn 25ppt; hàm lượng DO 5–7 mg/L; pH 7,5–8,5 và độ kiềm 100–150 mg/L CaCO3, và 50% lượng nước được thay 3 ngày một lần.
Kết quả về ảnh hưởng của hỗn hợp probiotics và chitosan đến hiệu suất tăng trưởng ở tôm thẻ chân trắng được trình bày trong Bảng 1. Sau 5 tuần, tôm được cho ăn bằng synbiotics PSC và ASC cho thấy sự khác biệt đáng kể về FW, WG, LG, ADG, SGR và FCR so với đối chứng (P<0,05). Tuy nhiên, nhóm PSC cho thấy giá trị của một số thông số cao hơn đáng kể so với các nhóm khác (P <0,05), đặc biệt là giá trị FL, WG, LG và SGR tương ứng. Ngoài ra, FCR của tôm ở lô đối chứng cao hơn đáng kể so với các nghiệm thức còn lại, (P<0,05). Tỷ lệ sống (SR) sau 5 tuần có sự khác biệt đáng kể giữa các nhóm được thử nghiệm, đặc biệt là nhóm PSC và ASC, tỷ lệ sống của nhóm này cao hơn đáng kể so với các nhóm khác (P<0,05).

Sự biểu hiện tương đối của các gen Rap-2a và GF-II trong gan tụy của tôm thí nghiệm được trình bày trong Hình 1. Gen Rap-2a được biểu hiện rõ rệt ở tôm được cho ăn hỗn hợp synbiotics PAC, PSC và ASC ở tuần 1, tuần 3 và tuần 5 tương ứng (Hình 1a). Sự biểu hiện của gen GF-II trong gan tụy rõ ràng là cao vào tuần thứ 3 và được điều chỉnh tăng đáng kể đối chứng và các nghiệm thức khác (P<0,05) (Hình 1b). Sự biểu hiện của Rap-2a trong ruột của tất cả các nhóm được bổ sung synbiotic được điều chỉnh đáng kể ở tuần thứ 3 so với ở nhóm đối chứng và C (P<0,05). Tuy nhiên, ở tuần thứ 5, nhóm bổ sung PSC và ASC cho thấy mức mRNA của gen này có ý nghĩa cao so với nhóm chứng, áo khoác và ASC (P<0,05) (Hình 1c).

Hình 1. Kết quả phân tích định lượng RT-PCR thời gian thực của các gen liên quan đến tăng trưởng. (A) Gen Rap-2a và (b) GF-II trong gan tụy và (c) Gen Rap-2a trong ruột.
Số bản sao DNA của các dòng lợi khuẩn B. amyloliquefaciens, B. pumilus và B. subtilis được xác định bằng qPCR với cặp mồi được thiết kế đặc biệt cho gen 16S rRNA của 3 chủng vi khuẩn này. Số lượng bản sao DNA/100ng của gen 16S rRNA từ ruột tôm trong quá trình thử nghiệm được trình bày trong Hình 2. Trước khi tiến hành thử nghiệm này, số lượng bản sao DNA của vi khuẩn trong ruột của tôm thử nghiệm là rất thấp, với nồng độ 8,56 ± 1,19 bản sao/100ng DNA. Tuy nhiên, sau tuần 1, số lượng bản sao DNA cao nhất được tìm thấy ở nhóm ASC, tiếp theo là nhóm PSC, với các giá trị lần lượt là 1.560,50 ± 346,72 và 106,36 ± 69,17 bản sao/100ng DNA, cao hơn đáng kể so với các các nhóm khác (P<0,05). Sư phân bố của probiotic cũng cao ở tuần thứ 5, với nhóm PSC và PAC cho thấy sự gia tăng đáng kể số lượng bản sao DNA, với các giá trị 1.119,50 ± 165,70 và 376,23 ± 176,60 số bản sao/100ng DNA, cao hơn đáng kể so với các giá trị đối với các nhóm khác (P<0,05) (Hình 2).

Hình 2. Kết quả phân tích định lượng PCR thời gian thực của số lượng bản sao DNA của gen 16S RNA của các nghiệm thức trong thí nghiệm
Kết quả của các phân tích cấu trúc mô học ruột cho thấy, tôm ở tất cả các nhóm được cho ăn bổ sung synbiotic có chiều cao biểu mô tốt hơn và độ dày thành ruột ở cả khu vực gan tụy và vùng bụng (Hình 3 và Hình 4, tương ứng). Khi điều tra các thông số này, người ta thấy rằng sử dụng thức ăn ở các nghiệm thức PSC và PAC có chiều cao biểu mô cao hơn đáng kể so với các nhóm khác (P<0,05), với giá trị tương ứng là 0,074 ± 0,015 và 0,062 ± 0,025mm (Hình 5a). Tuy nhiên, độ dày thành ruột của chỉ nhóm PAC synbiotic cao hơn đáng kể so với các nhóm khác, với giá trị 0,057 ± 0,022mm (Hình 5b).


Hình 5. Chiều cao biểu mô (a) và độ dày thành ruột của 3 con tôm khác nhau (S1 – S3) (b) của mỗi nhóm
Không tìm thấy sự khác biệt về phân bố kích thước trong gan tụy giữa các nghiệm thức. Tuy nhiên, sự khác biệt về cấu trúc mô học gan tụy đã được quan sát thấy trong thí nghiệm này, với các cấu trúc độc đáo được quan sát thấy ở từng nghiệm thức. Trong lô đối chứng, mô học gan tụy khác nhau giữa các tế bào F, B và R, cũng như kích thước ống (Hình 6). Tôm trong nhóm C và nhóm ASC cho thấy các ống lớn và lumen lớn với nhiều tế bào B lớn. Nhóm PAC cho thấy các kích thước ống không liền nhau, và các loại tế bào khác nhau, chủ yếu là tế bào F và R, có nhiều trong nhóm này. Điều thú vị là nhóm PSC cho thấy các ống nhỏ, và nhiều tế bào B nhỏ với các ống cô đặc cao được quan sát thấy ở mỗi cá thể tôm (Hình 6).
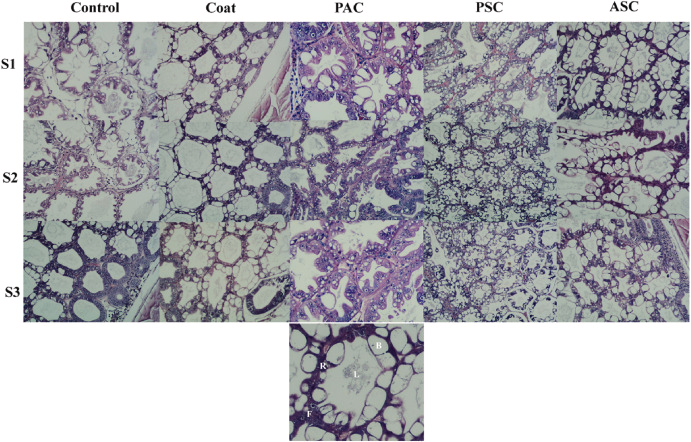
Hình 6. Phân tích mô học gan tụy của 3 cá thể tôm khác nhau (S1 – S3) của mỗi nghiệm thức được xử lý so với đối chứng. Đặc điểm sinh lý chung của ruột tôm bình thường bao gồm L = lumen, tế bào B = B, tế bào F = F và tế bào R = R
Trong thí nghiệm này, tác động của synbiotics lên các cơ chế miễn dịch tế bào, chẳng hạn như tổng số tế bào máu và hoạt động thực bào (PA), đã được đánh giá (Hình 7). Tuy nhiên, trong mỗi tuần thử nghiệm, không có sự khác biệt đáng kể về tổng số lượng huyết cầu giữa tất cả các nghiêm thức được điều trị cho đến khi kết thúc thử nghiệm này (P>0,05) (Hình 7a). PA ở nhóm PAC, PSC và ASC cao hơn đáng kể so với đối chứng ở tuần thứ 3 và thứ 5 (P<0,05) nhưng không khác biệt so với nhóm C (Hình 7b). Đối với chỉ số thực bào (PI), sự khác biệt đáng kể chỉ được quan sát thấy trong tuần thứ 5, vì tôm thí nghiệm thu được từ thức ăn có bổ sung PAC và PSC biểu hiện PI cao hơn đáng kể so với tôm ở nhóm đối chứng và nhóm áo (P<0,05) (Hình 7c).

Hình 7. Kết quả phân tích thông số miễn dịch của tôm (n = 9) của mỗi nghiệm thức
Sự biểu hiện của các gen ALF, LSZ, proPO và SOD trong mỗi cơ quan được trình bày trong Hình 8. Đối với biểu hiện gen tương đối ở mang, sự điều chỉnh của gen ALF cao hơn đáng kể ở nhóm PSC và ASC ở tuần 1 so với ở các nhóm khác (P<0,05) (Hình 8a). Hơn nữa, chỉ có nhóm PSC cho thấy mức độ biểu hiện của gen ALF cao hơn đáng kể so với nhóm đối chứng và các nhóm khác trong tuần 1-5 (P<0,05). Biểu hiện gen LSZ được quan sát thấy được điều chỉnh đáng kể chỉ ở nhóm ASC ở tuần thứ nhất so với các nhóm được thử nghiệm khác (P<0,05) (Hình 8b). Sự điều hòa gen proPO ở nhóm PAC và ASC cao hơn đáng kể so với các nhóm khác ở cả tuần 1 và 5 (P<0,05) (Hình 8c). Tuy nhiên, biểu hiện proPO cao hơn đáng kể ở mang ở tuần thứ 3 chỉ được quan sát thấy ở nhóm được điều trị bằng PSC (P<0,05). Vào tuần thứ nhất, sự gia tăng đáng kể biểu hiện gen SOD chỉ được ghi nhận ở nhóm PAC (P<0,05). Hơn nữa, ở tuần thứ 3, sự biểu hiện của SOD trong mang của tôm được cho ăn với synbiotics PAC và PSC được phát hiện có sự khác biệt đáng kể so với ở các nhóm khác (P<0,05), trong khi sự biểu hiện của gen SOD cao hơn đáng kể được ghi nhận chỉ ở nhóm PSC ở tuần thứ 5 (P<0,05) (Hình 8d).

Hình 8. Kết quả phân tích định lượng RT–PCR thời gian thực của 4 gen liên quan đến miễn dịch (ALF; yếu tố chống lipopolysaccharide, LSZ; lysozyme, proPO; propnoloxidase và SOD; superoxide dismutase) ở mang (a–d), huyết cầu (e–h), gan tụy (i–l) và ruột (m–p)
Chỉ tiêu tỷ lệ sống của tôm sau khi cảm nhiễm với VPAHPND1.2 được thực hiện bằng phương pháp Kaplan-Meier. Sau khi tiêm, tỷ lệ sống giảm nhanh từ 0 đến 24 giờ và giảm từ 24 đến 48 giờ. Trong thời gian phơi nhiễm, tại thời điểm 24 giờ, tỷ lệ chết ở nhóm PAC, PSC và ASC thấp hơn đáng kể so với nhóm chứng (P<0,05). Tuy nhiên, từ giờ 48 đến khi kết thúc thử nghiệm, khả năng kháng bệnh đối với VPAHPND1.2 của tôm ở nhóm PAC, PSC và ASC cao hơn đáng kể so với nhóm đối chứng (P<0,05), với tỷ lệ sống là 41,7 ± 11,55, 41,7 ± 0,00, 52,8 ± 5,77 và 22,2 ± 5,77%, tương ứng (P<0,05). Trong giai đoạn này, chỉ có tỷ lệ sống sót ở nhóm ASC cao hơn đáng kể so với nhóm C (P<0,05). Tôm ở nhóm không được cảm nhiễm không ghi nhận hiện tượng chết (tỷ lệ sống 100%). Ngoài ra, mẫu tôm chết được lấy ngẫu nhiên từ các nhóm thử nghiệm cho thấy rõ ràng sự thay đổi mô bệnh học của AHPND, với sự thoái hóa biểu mô bong tróc nghiêm trọng của tế bào gan tụy, và nhiều khuẩn lạc xanh được phân lập từ tôm bệnh bằng cách sử dụng thạch TCBS.

Hình 9. Tỷ lệ sống cộng đồng (%) ở các nghiệm thức trong thí nghiệm được phân tích bằng phương pháp Kaplan-Meier (a) (dấu hoa thị cho thấy sự khác biệt đáng kể, P<0,05) và mô bệnh học của tôm chết (b). Biểu mô bong tróc được chỉ định bởi ký hiệu S.
Tóm lại, nghiên cứu này đã chứng minh rằng việc bổ sung thức ăn cho tôm với synbiotics mạnh bao gồm chitosan và Bacillus spp. cải thiện năng suất sinh trưởng, tăng biểu hiện của các gen liên quan đến miễn dịch, cải thiện sự điều hòa miễn dịch của các thông số miễn dịch và cải thiện khả năng kháng bệnh sau khi cảm nhiễm với VPAHPND. Cuối cùng, thông tin thu được từ tất cả các kết quả là rất quan trọng để phát triển các phương pháp thực tế có thể giúp cải thiện hiệu quả sản lượng tôm trong ngành nuôi trồng thủy sản bằng cách nâng cao tốc độ tăng trưởng và phản ứng miễn dịch, và ASC cộng sinh được khuyến nghị để có được khả năng kháng bệnh mạnh đối với VPAHPND.
ThS. Chinh Lê
Học viện Nông nghiệp Việt Nam
- Grobest vững vàng sứ mệnh tiên phong vì sự phát triển bền vững của ngành tôm
- Hội nghị Thượng đỉnh Tôm TCRS 2025: Ngành tôm toàn cầu tìm giải pháp ứng phó thách thức
- Khuyến cáo các biện pháp phòng, chống nắng nóng cho thủy sản nuôi
- Quảng Ninh xây dựng cơ sở dữ liệu điện tử cho toàn ngành nuôi tôm
- Diện tích nuôi trồng thủy sản ước đạt 8.965ha
- Thuỷ sản Nam Việt (ANV): Lãi nửa đầu năm tăng 18 lần, hướng đến mức lãi 1.000 tỷ đồng
- Sợ phải “chân lấm tay bùn” nên ít thí sinh chọn học ngành Nuôi trồng thủy sản
- Xuất khẩu tôm sang Mỹ đối mặt nhiều áp lực
- Đầu tư nhà lưới, người nuôi tôm Nghệ An thích ứng với thời tiết nắng nóng
- “Thủ phủ tôm” trước cơ hội lớn
Tin mới nhất
T7,19/07/2025
- Grobest vững vàng sứ mệnh tiên phong vì sự phát triển bền vững của ngành tôm
- Hội nghị Thượng đỉnh Tôm TCRS 2025: Ngành tôm toàn cầu tìm giải pháp ứng phó thách thức
- Khuyến cáo các biện pháp phòng, chống nắng nóng cho thủy sản nuôi
- Quảng Ninh xây dựng cơ sở dữ liệu điện tử cho toàn ngành nuôi tôm
- Diện tích nuôi trồng thủy sản ước đạt 8.965ha
- Thuỷ sản Nam Việt (ANV): Lãi nửa đầu năm tăng 18 lần, hướng đến mức lãi 1.000 tỷ đồng
- Sợ phải “chân lấm tay bùn” nên ít thí sinh chọn học ngành Nuôi trồng thủy sản
- Xuất khẩu tôm sang Mỹ đối mặt nhiều áp lực
- Đầu tư nhà lưới, người nuôi tôm Nghệ An thích ứng với thời tiết nắng nóng
- “Thủ phủ tôm” trước cơ hội lớn
Các ấn phẩm đã xuất bản
- Người nuôi tôm phập phồng với “ngày nắng, đêm mưa”
- Động lực phát triển đột phá ngành thủy sản
- Công nghệ sinh học toàn diện: Giải pháp nuôi tôm thành công từ Tâm Việt
- Biện pháp kiểm soát khí độc Nitrite (NO2) trong mô hình nuôi tôm TLSS-547
- Ngành chức năng và nông dân Quảng Nam cùng gỡ khó cho nuôi tôm nước lợ
- Thời tiết bất lợi gây thiệt hại hơn 27 triệu con tôm sú, tôm thẻ nuôi
- [Tuyển dụng] – Công ty TNHH Seven Hills Trading tuyển dụng nhiều vị trí hấp dẫn trong năm 2025
- Nhiều diện tích tôm nuôi của Nghệ An bị bệnh đốm trắng
- Nuôi tôm càng xanh VietGAP: Giảm chi phí, tăng lợi nhuận
- Thời tiết bất lợi, người nuôi tôm treo đùng
- An toàn sinh học: Giải pháp then chốt cho bài toán dịch bệnh thủy sản
- Sử dụng sóng siêu âm để tính sinh khối ao nuôi tôm
- Máy sưởi ngâm: Cách mạng hóa nghề nuôi tôm ở Việt Nam
- Waterco: Giải pháp thiết bị hàng đầu trong nuôi trồng thủy sản
- GROSHIELD: “Trợ thủ đắc lực” giúp tôm đề kháng vững vàng hàng ngày, sẵn sàng về đích
- Năm mới, nỗi lo cũ: “Làm sao để tăng cường đề kháng cho tôm?”
- Vi sinh: Giải pháp mục tiêu toàn diện
- Grobest Việt Nam: Tiên phong ra mắt sản phẩm thức ăn chức năng hàng ngày Groshield, nâng cao tối đa sức đề kháng, hướng đến những vụ tôm về đích thành công trong năm tới
- Solagron Vietnam: Nhà sản xuất vi tảo công nghiệp đầu tiên mang dấu ấn Việt Nam
- Giải pháp giảm phát thải trong nuôi trồng thủy sản từ bột cá thủy phân














































