[Tạp chí Người Nuôi Tôm] – Trong nghiên cứu của Đại học Putra Malaysia, synbiotic được tạo ra bằng cách kết hợp men vi sinh L. plantarum L20 với bột prebiotic rong nâu S. polycystum, được tích hợp vào thức ăn cho tôm. Công thức này mang lại tác dụng hiệp đồng, tăng cường hiệu suất tăng trưởng, đáp ứng miễn dịch và khả năng kháng bệnh AHPND trên tôm nuôi.

Rong nâu (S. polycystum) (Ảnh: Tép Bạc)
Phương pháp nghiên cứu
Ấu trùng post của tôm sú (P. monodon) khỏe mạnh có kích thước khoảng 10mg được chọn ngẫu nhiên từ trại giống ở Teluk Senangin, Perak, Malaysia. 600 con tôm được đưa đến trại giống của Viện Khoa học Sinh học, Đại học Putra Malaysia, Serdang, Malaysia. Trong quá trình thích nghi, 200 con tôm được phân bố ngẫu nhiên vào ba bể nhựa (500L). Tôm được cho ăn 3 lần/ngày với chế độ ăn đối chứng và 4% thức ăn mỗi lần theo trọng lượng cơ thể và nuôi trong 7 ngày với 30‰ nước biển tự nhiên được lọc và xử lý bằng tia cực tím. Các bể được trang bị sục khí, phủ vải nhựa đen để cản ánh sáng và lò sưởi để kiểm soát nhiệt độ ở khoảng 27°C. Tất cả các bể được đặt trong cùng một không gian và diện tích của trại giống để duy trì cùng điều kiện môi trường.
Bốn khẩu phần thử nghiệm bao gồm khẩu phần đối chứng không bổ sung probiotic và prebiotic và ba khẩu phần thử nghiệm gồm khẩu phần probiotic (PRO) chứa 108CFU/g L. plantarum L20, khẩu phần prebiotic (PRE) chứa 2% bột S. polycystum và chế độ ăn tổng hợp (SYN) chứa 108CFU/g L. plantarum L20 và 2% bột S. polycystum đã được chuẩn bị. Trước khi chuẩn bị khẩu phần, thức ăn cơ bản (Star Feedmill, Beranang, Malaysia; protein thô 40%, chất béo thô 5%, chất xơ thô 3%, độ ẩm 12%) được nghiền để đi qua sàng lưới.
Sau khi thích nghi, 600 cá thể tôm được phân vào 12 bể nhựa (90cm × 60cm × 30cm) thể tích 100L (50 con/bể × 4 nhóm × 3 lần lặp lại). Các nhóm bao gồm nhóm đối chứng (CON), nhóm probiotic (PRO), nhóm prebiotic (PRE) và nhóm synbiotic (SYN). Tất cả các bể được đặt trong cùng một không gian và diện tích của trại giống để duy trì cùng điều kiện môi trường. Tôm được cho ăn 3 lần/ngày trong 35 ngày với các khẩu phần thí nghiệm, tương ứng với 4% trọng lượng cơ thể. Trong thử nghiệm tăng trưởng, cân nặng được đo vào lúc bắt đầu thử nghiệm, sau 7 ngày và sau 35 ngày. Vào ngày thứ 35, các phép đo bao gồm chiều dài và trọng lượng cuối cùng của tôm cũng như trọng lượng khô của thức ăn thừa được ghi lại để tính toán các thông số liên quan đến tăng trưởng.
Kết quả về hiệu suất tăng trưởng
Cân nặng và mức tăng cân cuối cùng cao hơn đáng kể ở nhóm PRO, nhóm PRE và nhóm SYN (p<0,05) so với nhóm đối chứng nhưng không khác biệt đáng kể (p>0,05) giữa nhóm PRO, nhóm PRE và nhóm SYN (Bảng 1). Tốc độ tăng trưởng cụ thể và tỷ lệ chuyển đổi protein cao hơn (p<0,05) ở nhóm PRO và PRE so với nhóm đối chứng, nhưng tốc độ tăng trưởng cụ thể và tỷ lệ chuyển đổi protein ở nhóm SYN cao nhất (p <0,05) trong số các nhóm. Tỷ lệ chuyển đổi thức ăn ở nhóm PRO và PRE (p<0,05) thấp hơn so với nhóm đối chứng, nhưng tỷ lệ chuyển đổi thức ăn ở nhóm SYN lại thấp nhất (p <0,05) trong số các nhóm (Bảng 1). Không có sự khác biệt đáng kể (p>0,05) về khả năng sống sót giữa tất cả các nhóm. Tất cả tôm đại diện đều có màu gan tụy bình thường từ Nhóm PRO, PRE, SYN và đối chứng.
Bảng 1. Các thông số về hiệu suất tăng trưởng của tôm trong thí nghiệm
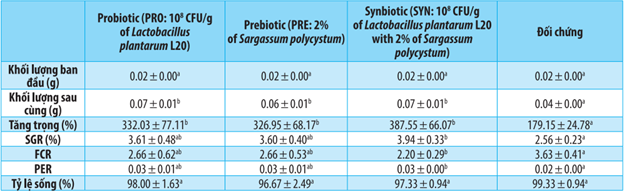
Chữ cái chỉ số trên khác nhau biểu thị sự khác biệt đáng kể (p < 0,05) của cùng một hàng.
Kết quả về tỷ lệ sống của tôm sau cảm nhiễm
Tỷ lệ sống của nhóm PRE cao hơn đáng kể (p<0,05) so với nhóm đối chứng, nhưng tỷ lệ sống của nhóm PRO và SYN cao hơn đáng kể (p<0,05) trong số tất cả các nhóm (Hình 1).
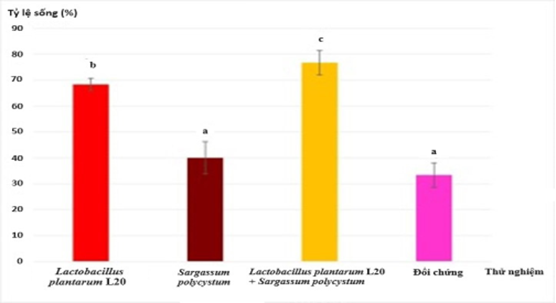
Hình 1. Tỷ lệ sống của tôm ở các nghiệm thức khác nhau sau thử thách ngâm ở mức 6×105 CFU/mL Vibrio parahaemolyticus S2–4 vào ngày thứ 3 (60h) sau cảm nhiễm.
Kết quả về biểu hiện gen miễn dịch của tôm sú trong thí nghiệm
Đối với cephalothorax ở tôm trong thử nghiệm cho ăn, lipopolysaccharide và protein gắn với β-1,3-glucan (LGBP), peroxinectin, prophenoloxidase và lysozyme được điều chỉnh tăng đáng kể (p<0,05) nhưng giống như thụ thể thu phí, crusin, penaeidin và HSP70 được điều chỉnh giảm đáng kể (p<0,05) so với Nhóm PRO và SYN so với nhóm đối chứng. LGBP, peroxinectin, thụ thể giống thu phí và HSP70 được điều chỉnh giảm đáng kể (p<0,05), cructin, penaeidin và lysozyme không khác biệt đáng kể (p>0,05), prophenoloxidase được điều chỉnh tăng đáng kể (p <0,05) so với Nhóm PRE so sánh với nhóm đối chứng.
Đối với bụng tôm trong thử nghiệm cho ăn, LGBP, thụ thể giống thu phí, HSP70 được điều chỉnh giảm đáng kể (p<0,05), nhưng được điều chỉnh tăng đáng kể (p<0,05) từ Nhóm PRO, PRE và SYN so với nhóm đối chứng. Crustin và penaeidin được điều chỉnh giảm đáng kể (p<0,05) so với Nhóm PRO và SYN, nhưng không khác biệt đáng kể (p>0,05) so với nhóm đối chứng. Peroxinectin được điều chỉnh tăng đáng kể (p <0,05) so với Nhóm PRO trong khi prophenoloxidase được điều chỉnh giảm đáng kể (p<0,05) so với Nhóm PRE, nhưng các nhóm còn lại không khác biệt đáng kể (p>0,05) đối với hai gen so với nhóm kiểm soát.
Đối với cephalothorax tôm trong thử nghiệm cảm nhiễm, LGBP, peroxinectin và HSP70 được điều chỉnh giảm đáng kể (p <0,05), lớp vỏ không khác biệt đáng kể (p>0,05) nhưng thụ thể giống toll và penaeidin tăng đáng kể- được quy định (p<0,05) từ Nhóm PRO, PRE và SYN so với nhóm đối chứng. Prophenoloxidase và lysozyme được điều chỉnh tăng đáng kể (p <0,05) từ Nhóm PRO nhưng được điều chỉnh giảm đáng kể (p<0,05) từ Nhóm PRE so với nhóm đối chứng. Nhóm SYN biểu hiện prophenoloxidase được điều chỉnh tăng đáng kể (p<0,05) nhưng lysozyme được điều chỉnh giảm đáng kể (p<0,05) so với nhóm đối chứng.
Đối với bụng tôm trong thử nghiệm cảm nhiễm, LGBP và lớp vỏ không khác biệt đáng kể (p>0,05), peroxinectin được điều chỉnh giảm đáng kể (p<0,05) nhưng thụ thể giống thu phí được điều chỉnh tăng đáng kể (p< 0,05) từ Nhóm PRO, PRE và SYN so với nhóm đối chứng. Prophenoloxidase được điều chỉnh tăng đáng kể (p<0,05) trong khi penaeidin được điều chỉnh giảm đáng kể (p<0,05) so với Nhóm PRO và SYN nhưng Nhóm PRE không có sự khác biệt đáng kể (p>0,05) đối với prophenoloxidase và được điều chỉnh tăng đáng kể đối với penaeidin so với nhóm đối chứng. Lysozyme và HSP70 không khác biệt đáng kể (p>0,05) so với Nhóm PRO và PRE nhưng giảm đáng kể (p<0,05) so với Nhóm SYN.
Kết quả định lượng Vibrio parahaemolyticus gây AHPND ở tôm sú
Giá trị CT của gen độc tố pirA cho thấy nồng độ V. parahaemolyticus gây AHPND bằng cách tham khảo đường cong chuẩn, cho thấy V. parahaemolyticus gây AHPND khả thi bao gồm cả chủng S2–4 ở tôm (Hình 2). Không xác định được nồng độ V. parahaemolyticus gây AHPND vì không phát hiện thấy gen pirA ở đầu ngực và bụng tôm của tất cả các nhóm trong ngày thử nghiệm cho ăn thứ 35. Trong thử thách sau 60h sau khi ngâm với 6×105 CFU/mL V. parahaemolyticus S2–4, nồng độ V. parahaemolyticus gây AHPND là 6,410±0,291 Log10 CFU/mL và 4,936±0,099 Log10 CFU/mL được thể hiện đáng kể (p<0,05) cao nhất lần lượt ở phần đầu ngực và phần bụng của tôm ở nhóm đối chứng so với các nhóm khác. Tuy nhiên, nồng độ thấp nhất của V. parahaemolyticus gây AHPND được biểu hiện đáng kể (p<0,05) ở tôm thuộc nhóm probiotic và synbiotic tương ứng là 4,244±0,409 Log10 CFU/mL và 4,504±0,203 Log10 CFU/mL tương ứng ở cephalothorax, 3,713±0,246 Log10 CFU/mL và 4,128±0,331 Log10 CFU/mL tương ứng ở bụng.
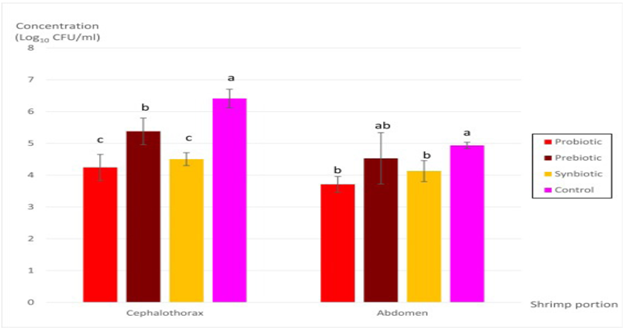
Hình 2. Định lượng so sánh Vibrio parahaemolyticus gây AHPND bằng cách sử dụng gen độc tố pirA cụ thể ở vùng đầu ngực và bụng của tôm sú được cho ăn bằng các loại thức ăn bổ sung khác nhau trong 60h với 6×105 CFU/mL V. parahaemolyticus S2–4 trong thử nghiệm cảm nhiễm ngâm.
Tóm lại, nghiên cứu này đã cho thấy rằng thức ăn được bổ sung synbiotic chứa L. plantarum L20 và rong nâu S. polycystum đã cải thiện hiệu suất tăng trưởng, phản ứng miễn dịch bẩm sinh và tăng cường khả năng sống sót của tôm sú so với probiotic và prebiotic. Về mặt quan điểm, thức ăn bổ sung synbiotic có thể được sử dụng để chống lại AHPND trong nuôi trồng thủy sản và có tiềm năng ứng dụng trong thực tế sản xuất.
Th.S Chinh Lê (Lược dịch)
Học viện Nông nghiệp Việt Nam
- Kiểm soát, giảm thiểu rác thải nhựa ngành thủy sản
- Tổng thư ký VASEP: Đầu tư nuôi tôm công nghệ cao có thể đem lại cho GDP hàng nghìn tỷ đồng
- Thanh Hóa: Mô hình “Nuôi tôm thẻ chân trắng thâm canh công nghệ cao” giúp phát triển bền vững, thân thiện môi trường
- Thủy sản Việt Nam cần mô hình cảnh báo môi trường biển thông minh
- Làm giàu từ mô hình nuôi tôm quảng canh cải tiến
- Hiệu quả từ ứng dụng nuôi tôm công nghệ cao
- Hà Tĩnh: Tổng sản lượng thủy sản trong 6 tháng đầu năm đạt 29.414 tấn
- Nhiều diện tích tôm nuôi bị dịch bệnh
- Nuôi trồng thủy sản điều hướng biến động thương mại với động lực cung ứng mạnh mẽ
- Cà Mau: Phát triển mạnh nuôi tôm sinh thái
Tin mới nhất
CN,13/07/2025
- Kiểm soát, giảm thiểu rác thải nhựa ngành thủy sản
- Tổng thư ký VASEP: Đầu tư nuôi tôm công nghệ cao có thể đem lại cho GDP hàng nghìn tỷ đồng
- Thanh Hóa: Mô hình “Nuôi tôm thẻ chân trắng thâm canh công nghệ cao” giúp phát triển bền vững, thân thiện môi trường
- Thủy sản Việt Nam cần mô hình cảnh báo môi trường biển thông minh
- Làm giàu từ mô hình nuôi tôm quảng canh cải tiến
- Hiệu quả từ ứng dụng nuôi tôm công nghệ cao
- Hà Tĩnh: Tổng sản lượng thủy sản trong 6 tháng đầu năm đạt 29.414 tấn
- Nhiều diện tích tôm nuôi bị dịch bệnh
- Nuôi trồng thủy sản điều hướng biến động thương mại với động lực cung ứng mạnh mẽ
- Cà Mau: Phát triển mạnh nuôi tôm sinh thái
Các ấn phẩm đã xuất bản
- Người nuôi tôm phập phồng với “ngày nắng, đêm mưa”
- Động lực phát triển đột phá ngành thủy sản
- Công nghệ sinh học toàn diện: Giải pháp nuôi tôm thành công từ Tâm Việt
- Biện pháp kiểm soát khí độc Nitrite (NO2) trong mô hình nuôi tôm TLSS-547
- Ngành chức năng và nông dân Quảng Nam cùng gỡ khó cho nuôi tôm nước lợ
- Thời tiết bất lợi gây thiệt hại hơn 27 triệu con tôm sú, tôm thẻ nuôi
- [Tuyển dụng] – Công ty TNHH Seven Hills Trading tuyển dụng nhiều vị trí hấp dẫn trong năm 2025
- Nhiều diện tích tôm nuôi của Nghệ An bị bệnh đốm trắng
- Nuôi tôm càng xanh VietGAP: Giảm chi phí, tăng lợi nhuận
- Thời tiết bất lợi, người nuôi tôm treo đùng
- An toàn sinh học: Giải pháp then chốt cho bài toán dịch bệnh thủy sản
- Sử dụng sóng siêu âm để tính sinh khối ao nuôi tôm
- Máy sưởi ngâm: Cách mạng hóa nghề nuôi tôm ở Việt Nam
- Waterco: Giải pháp thiết bị hàng đầu trong nuôi trồng thủy sản
- GROSHIELD: “Trợ thủ đắc lực” giúp tôm đề kháng vững vàng hàng ngày, sẵn sàng về đích
- Năm mới, nỗi lo cũ: “Làm sao để tăng cường đề kháng cho tôm?”
- Vi sinh: Giải pháp mục tiêu toàn diện
- Grobest Việt Nam: Tiên phong ra mắt sản phẩm thức ăn chức năng hàng ngày Groshield, nâng cao tối đa sức đề kháng, hướng đến những vụ tôm về đích thành công trong năm tới
- Solagron Vietnam: Nhà sản xuất vi tảo công nghiệp đầu tiên mang dấu ấn Việt Nam
- Giải pháp giảm phát thải trong nuôi trồng thủy sản từ bột cá thủy phân














































